リンパ腫研究室
錦織 桃子(人間健康科学系専攻 臨床研究開発学分野 教授)
有馬 浩史(助教)
中尾 健介(研修員)、郭 玉娟(大学院2年生)、森田彩巴(大学院2年生)
城 友泰(検査部・細胞療法センター 助教)、岩﨑 惇(医員)、戸田 有亮(細胞機能制御学教室 研究生)、田矢 知大(細胞機能制御学教室 研究生)
研究室紹介
当研究室では、主にB細胞リンパ腫の病態解明に関わる研究を行っています。
悪性リンパ腫の発症機序や免疫微小環境に焦点を当てたアプローチにより、新規治療法開発の糸口を見つけ、将来の臨床に貢献できるような研究を目指したいと考えています。
研究内容
悪性リンパ腫におけるエピゲノム修飾に関する研究
濾胞性リンパ腫では、エピゲノム修飾に関与する分子の遺伝子異常が高頻度に存在することが知られています。当研究室では、濾胞性リンパ腫のエピゲノム修飾異常の意義やエピゲノム修飾薬の作用メカニズムを明らかにする研究に取り組んでいます。
EZH2は、ヒストンメチル基転移酵素であるポリコーム抑制複合体のサブユニットであり、標的遺伝子のプロモータ領域のH3K27をトリメチル化(H3K27me3)し、特定の遺伝子群の発現を抑制する作用を持っています。EZH2の機能獲得型変異は、濾胞性リンパ腫の約2割に生じており、これにより胚中心以降のB細胞分化が阻害されることが示されています。
CD58は、抗原提示細胞がT細胞と安定した免疫シナプスを形成する際に重要な役割を果たす細胞表面分子ですが、悪性リンパ腫ではしばしば発現が低下することが知られています。当研究室では、エピゲノム修飾薬を用いたスクリーニングにより、2種類のEZH2阻害薬(Tazemetostat, GSK126)が特異的にCD58低発現B細胞リンパ腫細胞株のCD58発現を回復させる作用を持つことを発見しました(大塚ら、Mol Immunol. 2020;119:35-45)。また、B細胞リンパ腫細胞株をEZH2阻害薬で処理すると、共培養したT細胞およびNK細胞のIFN-γ産生が増加しました。これから、EZH2阻害薬は悪性リンパ腫のCD58発現を回復させることで抗腫瘍免疫応答を増強する作用が考えられます。
さらに、EZH2阻害薬はB細胞リンパ腫細胞株においてCCL17/TARCの発現を促進し、T細胞の遊走を増加させることが判明しました(Yuanら、Cancer Sci. 2021;112:4604-16)。CCL17/TARCはホジキンリンパ腫のH/RS細胞に特異的に高発現し、T細胞が豊富な腫瘍微小環境の形成に関与しています。また、TazemetostatはH/RS細胞に特異的な遺伝子群の発現を上昇させることも示されました。これらの知見から、異なる悪性リンパ腫の病型の背景にはエピゲノム修飾の違いが存在する可能性が推測されます。
EZH2阻害薬は濾胞性リンパ腫の病態に基づいて開発が進められ、臨床応用に至った薬剤ですが、これらの研究により悪性リンパ腫の新たな側面が明らかにされつつあります。当研究室では、引き続き悪性リンパ腫におけるエピゲノム修飾に関する研究に取り組んでいます。
B細胞リンパ腫におけるユビキチン修飾を介したシグナル改変に関する研究
B細胞リンパ腫では様々な細胞内シグナルが細胞の生存や増殖に関与しています。こうした細胞内シグナルはしばしば免疫微小環境に依存しており、免疫微小環境によるリンパ腫細胞の支援が抗がん剤による治療効果を低減させる要因にもなることが知られています。こうした免疫微小環境から受ける細胞内へのシグナルが、ユビキチン修飾機構を標的とした薬物によってユニークに改変できることに着目し、企業との共同研究を行っています。
悪性リンパ腫におけるゲノム構造異常に関する研究
ゲノム構造異常(SV)は、50bp以上の欠失、挿入、重複、逆位、および転座の総称です。悪性リンパ腫では古くから染色体転座を含むSVの検出が臨床で役立てられているものの、その全容に対する理解は不十分なままとなっています。SVは一塩基置換による変異(SNV)やShort INDELと比較して出現頻度は低いものの、その大きいサイズのために、SVに起因して変異する塩基数はSNV・INDELによるものより大幅に多いことが示されています。SVの構造の複雑さと大きいサイズのために、その包括的な検出と理解はSNV・INDELと比較してこれまで困難でした。
我々は、SVを評価するための新しいアルゴリズムによる次世代ゲノムシーケンスデータの解析を足掛かりとして、悪性リンパ腫におけるゲノムSVの未知なる意義の解明に取り組んでいます。
B細胞およびB細胞リンパ腫におけるNotchシグナルに関わる研究
近年の次世代ゲノムシーケンスによる解析により、B細胞リンパ腫の多くの病型で遺伝子変異によるNotchシグナルの活性化が引き起こされていることが分かってきました。Notchシグナルは、T細胞や神経、心筋など、多くの細胞や組織の分化や機能の制御に関与していることが知られています。しかし、成熟B細胞およびB細胞リンパ腫におけるNotchシグナル活性化の意義はまだ完全には解明されていません。
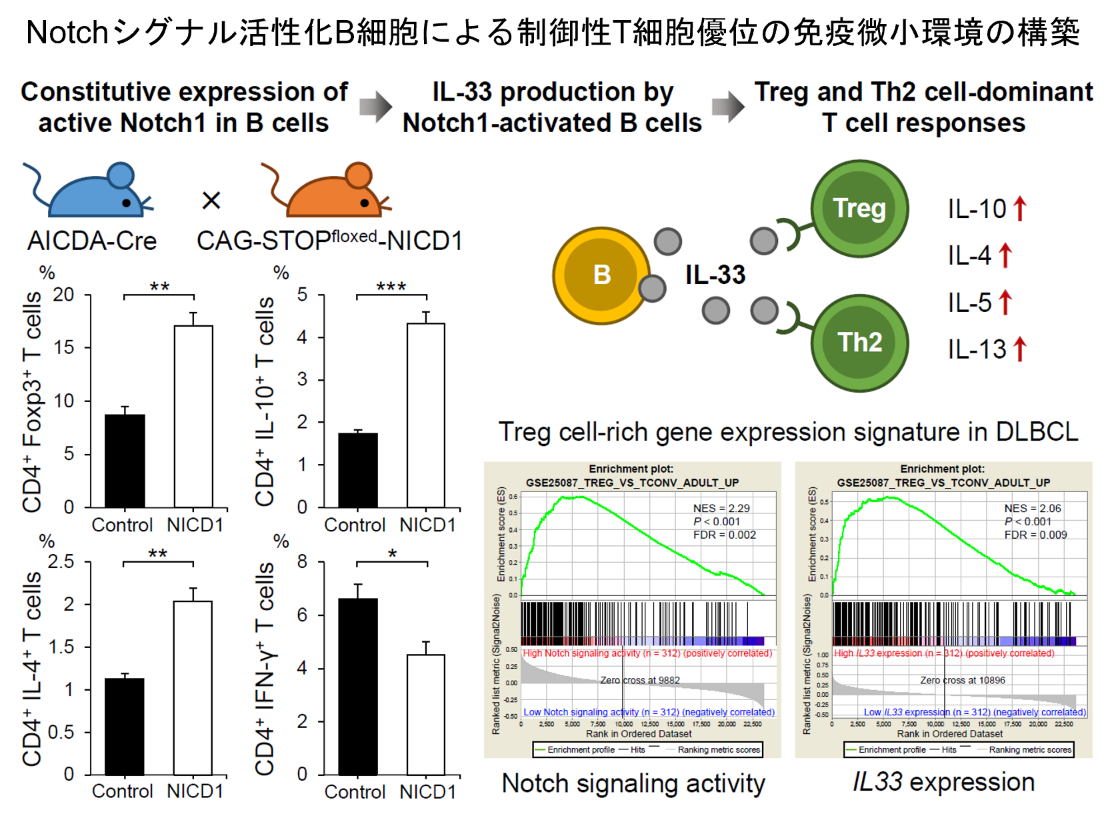
私たちは、B細胞およびB細胞リンパ腫におけるNotchシグナル活性化の役割を明らかにするため、AID-Creマウスを用いて、成熟B細胞で特異的にNotchシグナルが活性化される新しいモデルマウスを作製し、解析を行いました。このモデルマウスでは、二次リンパ組織において、免疫抑制性の制御性T(Treg)細胞および2型ヘルパーT(Th2)細胞が増加する一方で、1型ヘルパーT(Th1)細胞の割合およびCD8陽性T細胞におけるIFN-γ産生能が減少することが確認されました。さらに、モデルマウスにOvalbuminを発現するマウスメラノーマ細胞株を移植した実験により、モデルマウスでは腫瘍特異的なCD8陽性T細胞の形成能力が低下することが示されました。これらの結果から、成熟B細胞におけるNotchシグナルの活性化は、T細胞による抗腫瘍免疫応答を抑制する作用があることが分かりました。
さらに、網羅的な遺伝子発現比較解析を行った結果、Notchシグナル活性化成熟B細胞では、Treg細胞およびTh2細胞の誘導・活性化因子であるIL33遺伝子の発現が増加していることが示されました。また、NotchリガンドによるB細胞の刺激実験により、B細胞からのIL-33の細胞外分泌がNotchシグナルに依存して増加することが明らかにされました。さらに、Notchシグナル活性化B細胞と野生型T細胞の共培養実験により、Notchシグナル活性化B細胞がTreg細胞およびTh2細胞に対して、IL-10を含む免疫抑制性サイトカインの産生を促進することが明らかになりました。このT細胞によるサイトカイン産生の増加は、IL-33受容体のブロックによって打ち消されることから、Notchシグナル活性化B細胞から分泌されるIL-33が引き起こすことが確認されました。
さらに、ヒトびまん性大細胞型B細胞リンパ腫(DLBCL)の生検検体の大規模RNAシーケンスデータを用いてバイオインフォマティクス解析を行った結果、B細胞リンパ腫におけるNotchシグナルの活性化は、IL33遺伝子の発現と相関するだけでなく、Treg細胞が優位な腫瘍微小環境と関連していることが明らかになりました。これらの結果から、Notchシグナルの活性化およびIL-33の発現は、腫瘍の免疫逃避を助け、B細胞リンパ腫の進展に寄与すると考えられます。これらの成果により、B細胞が持つ新たな免疫調節機構の存在が示唆され、この機構を標的としたB細胞リンパ腫の新規治療法開発の可能性が示されました(有馬ら、Blood Advances. 2018;2(18):2282-95)。
クリックで拡大
主な研究業績
- Nakao K, Nishikori M, Fujimoto M, Arima H, Haga H, Takaori-Kondo A. Concurrent development of small lymphocytic lymphoma and lung cancer: A report of two cases and a review of the literature. Journal of Clinical and Experimental Hematopathology. 2023;63(2):132-8. doi:https://doi.org/10.3960/jslrt.22047
- Yuan H, Nishikori M, Otsuka Y, Arima H, Kitawaki T, Takaori-Kondo A. The EZH2 inhibitor tazemetostat upregulates the expression of CCL17/TARC in B-cell lymphoma and enhances T-cell recruitment. Cancer Science. 2021;112(11):4604-16. doi: https://doi.org/10.1111/cas.15122
- Moribe F, Nishikori M, Takashima T, Taniyama D, Onishi N, Arima H, Sasanuma H, Akagawa R, Elloumi F, Takeda S. Epigenetic suppression of SLFN11 in germinal center B-cells during B-cell development. PLoS One . 2021;16(1):e0237554. doi: https://doi.org/10.1371/journal.pone.0237554
- Otsuka Y, Nishikori M, Arima H, Izumi K, Kitawaki T, Hishizawa M, Takaori-Kondo A. EZH2 inhibitors restore epigenetically silenced CD58 expression in B-cell lymphomas. Molecular Immunology . 2020;119:35-45. doi: https://doi.org/10.1016/j.molimm.2020.01.006
- Jo T, Nishikori M, Kogure Y, Arima H, Sasaki K, Sasaki Y, Nakagawa T, Iwai F, Momose S, Shiraishi A, Kiyonari H, Kagaya N, Onuki T, Shin-ya K, Yoshida M, Kataoka K, Ogawa S, Iwai K, Takaori-Kondo A. LUBAC accelerates B-cell lymphomagenesis by conferring resistance to genotoxic stress on B cells. Blood. 2020;136(6):684-97. https://doi.org/10.1182/blood.2019002654
- Izumi K, Nishikori M, Yuan H, Otsuka Y, Nakao K, Takaori-Kondo A. Establishment and characterization of a MALT lymphoma cell line carrying an API2-MALT1 translocation. Genes Chromosomes Cancer 2020;59(9):517-24. doi: https://doi.org/10.1002/gcc.22855
- Otsuka Y, Nishikori M, Fujimoto M, Nakao K, Hishizawa M, Haga H, Takaori-Kondo A. Relapse of follicular lymphoma arising from a non-t(14;18) clone. eJHaem 2020;1(1):323-7. . doi: https://doi.org/10.1002/jha2.28
- Tamura N, Maeda H, Nishikori M, Fujita H, Hishizawa M, Haga H, Takaori-Kondo A. Histologic transformation of t (11; 18)-positive MALT lymphoma presented with aberrant T-cell marker expression. Int J Hematol. 2020;111:724–732. doi: https://doi.org/10.1007/s12185-019-02810-y
- Arima H, Nishikori M, Otsuka Y, Kishimoto W, Izumi K, Yasuda K, Yoshimoto T, Takaori-Kondo A. B cells with aberrant activation of Notch1 signaling promote Treg and Th2 cell–dominant T-cell responses via IL-33. Blood Adv. 2018:2: 2282–2295. doi: https://doi.org/10.1182/bloodadvances.2018019919
- Arima H, Fujimoto M, Nishikori M, Kitano T, Kishimoto W, Hishizawa M, Kondo T, Yamashita K, Hirata M, Haga H, Takaori-Kondo A. Prognostic impact of activation-induced cytidine deaminase expression for patients with diffuse large B-cell lymphoma. Leukemia & Lymphoma. 2018;59(9):2085-95.doi: https://doi.org/10.1080/10428194.2017.1410884
- Kishimoto W, Nishikori M, Arima H, Miyoshi H, Sasaki Y, Kitawaki T, Shirakawa K, Kato T, Imaizumi Y, Ishikawa T, Ohno H, Haga H, Ohshima K, Takaori-Kondo A. Expression of Tim-1 in primary CNS lymphoma. Cancer Med. 2016; 5(11):3235-3245. doi: https://doi.org/10.1002/cam4.930